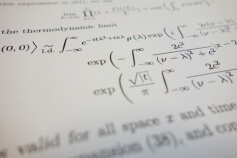Парциальное давление и объем
Смесям идеальных газов характерно свойство аддитивности двух показателей: парциального давления и объёма. Другими словами, любому включённому в смесь инертному газу характерно такое поведение, какое было бы, если б он в единственном числе заполнял предлагаемый объём. Для лучшего понимания разумно разобраться, что выражают указанные величины.
Давление – действующая на единицу поверхности сила, прямопропорциональная числу и скоростью сталкивающихся с этой поверхностью молекул, зависящей от температуры.
Парциальное давление – давление, оказываемое компонентом газовой смеси, при условии удаления других компонентов из занимаемого объёма, сохраняя этот объём и текущую температуру.
Объём – ограниченное чертой трёхмерное пространство, вмещающее вещество и отображающее его форму.
Парциальный объём – объём, занимаемый компонентом газовой смеси, при условии удаления других компонентов из занимаемого объёма, сохраняя первоначальное давление и температуру.
Идеальный газ – научная модель для познания газов, не учитывающая силу молекулярного взаимодействия.
Смесь идеальных газов – это совокупность газов, каждый из которого, находясь в смеси, при сохранении заданных условий, не вступает в химическую реакцию с остальными компонентами.
Говоря об идеальных газах и их смеси, следует понимать, что изменение условий, например температуры или давления, всё же может спровоцировать химическую реакцию. Важным параметром такой смеси является молярная (весовая) концентрация газового компонента. Данная величина измеряется в мг/м3 и показывает количество конкретного компонента в единице объёма газовой смеси.
Парциальное давление
Описывая характеристику состояния компонентов идеальной смеси газообразных веществ, парциальное давление, создаваемое i-ым газом в случае удаления других компонентов из сохраняемых условий, является показателем pi.
Формула парционального давления:
\[p i=\frac{m_{i}}{\mu_{i}} \frac{R T}{V}=\mu_{i} \frac{R T}{V}\]
Где V– объём смеси, R = 8,31
Дж/моль*K– универсальная газовая постоянная, а T –
температура.
Следует отметить, что равность средней кинетической энергии находящихся в смеси молекул определяет равенство температур всех компонентов термодинамически уравновешенной газовой смеси. Найти общее давление смеси идеальных газов представляется возможным через закон Дальтона, отражаемый аддитивность парциальных давлений, а именно \[p=\sum p_{i}\].
Пользуясь данным законом, найдём давление смеси идеальных газов через следующую формулировку: \[p=\sum_{i}^{N}=1 \rightarrow p_{i}=\frac{R T}{V} \sum_{i}^{N}=1^{v_{i}}\], где N – количество вошедших в смесь газов, vi– количественный показатель молей i-го газа. Отсюда парциальное давление можно выразить формулой \[p_{i}=x_{i} p\], где xi – молярная концентрация i-го газа.
Понятие парциального объёма
Описывая характеристику состояния компонентов идеальной смеси газообразных веществ, парциальный объём, занимаемый i-ым газом в случае удаления других компонентов из сохраняемых условий, является показателем Vi. Аддитивность парциального объёма определяет закон Амага, выраженный формулой \[V=\sum_{i}^{N}=1 V_{i}\].
Пользуясь данным законом, можно вывести формулу нахождения парциального объёма через следующую формулировку:
\[v_{i}=\frac{p^{V_{i}}}{R T}\]; \[p=\frac{R T}{V} \frac{p}{R T} \sum_{i}^{N}=\mathbf{1}^{V}_{i}\] , отсюда
следует, что — \[\boldsymbol{V=\sum_{i}^{N}=1^{V_{i}}}, \text{ а } \boldsymbol{V_{i}=x_{i} V}\].
Зная, что характеризующие состояние смеси инертных газов показатели подчиняются уравнению Менделеева-Клапейрона, выведем формулу:
\[p V=\frac{m}{\mu_{s m}} R T\] данное уравнение свои параметры относит ко всей газовой смеси.
\[pV=mR_{s m} T\] такой вариант уравнения содержит показатель Rsm, обозначающий удельную газовую составляющую смеси.
Уравнение Менделеева-Клапейрона показывает возможность изменения трёх характеризующих состояние идеального газа параметров.

Нет времени решать самому?
Наши эксперты помогут!
Контрольная
| от 300 ₽ |
Реферат
| от 500 ₽ |
Курсовая
| от 1 000 ₽ |
Примеры вычисления парциального давления и объёма
Задача №1
Условие: в сосуде объёмом 2 м3, при постоянной температуре 290 К находится 0,20*10-3 кг гелия и 1*10-3 кг водорода. Необходимо вычислить давление смеси и парциальное давление гелия.
Решение.
Сначала вычислим количество молей каждого компонента, используя следующую формулу:
Для расчёта количество молей водорода в смеси нам понадобится его молярная масса, которую возьмём из таблицы Менделеева:
Теперь можно найти количество молей водорода в смеси:
Зная молярную массу гелия из таблицы Менделеева, рассчитаем количество молей гелия в смеси:
Теперь можно найти парциальное давление каждого из компонентов с помощью уравнения Менделеева-Клапейрона:
Сначала нужно рассчитать давление водорода:
Рассчитаем парциальное давление гелия:
Теперь найдём полное давление газовой смеси, сложив значения компонентов:
Ответ: парциальное давление гелия равно 482 Па, а общее давление 1205 Па.
Задача №2
Условие: идеальная газовая смесь состоит из 0,5 кг углекислого газа и 0,25 кг кислорода, какой объём они займут, если давление равно 1 атм, а температура смеси равна 300 К?
Решение.
Найдём суммарную массу газовой смеси:
Вычислим массовые компоненты смеси:
Тогда газовая постоянная смеси равняется:
Пользуясь уравнением Менделеева-Клапейрона, и, зная, что 1 атм равна 105 Па,вычислим объём смеси:
Ответ: при заданных условиях смесь займёт 0,45 м3.
Навык определения парциальных давлений и объёма актуален в машиностроении, энергетике и других промышленностях, связанных с использованием тепловых двигателей, приводимых в действие парами высокой температуры.